钙敏感受体CaSR是一种C家族GPCR,主要分布在人体的甲状腺、甲状旁腺、骨骼、肠道系统以及肾脏等器官中,它能感应钙离子的浓度,通过平衡钙离子的吸收和外排从而维持人体中的钙离子平衡。CaSR 的失活性突变会引起高血钙疾病,而激活性突变会引起低血钙疾病。CaSR除了能够感受钙离子外,它还能够感受各种内源的氨基酸,氨基酸衍生物、多肽以及多胺化合物等。有关CaSR的生理、病理、细胞以及生化研究已经开展很多年,但是由于缺少全长CaSR的三维结构信息,其完整激活机制目前仍然不清楚,而且限制了靶向CaSR受体的相关药物研发。
近日, 中国科学技术大学生命科学与医学部田长麟教授团队联合清华大学刘磊教授团队在CaSR的结构与功能机制研究方面取得重要进展,相关成果以题为“Structural Mechanism of the Human Calcium-Sensing Receptor Cooperatively Activated by Ca2+ Ions and L-tryptophan”的研究长文形式发表在cell research杂志。该工作入选cell research 杂志四月封面文章(图1)。

图1 2021年Cell Research杂志第四期封面
(黄雯、陈磊、柏江竹设计制作)
该研究在国际上首次报道了人源全长钙敏感受体CaSR蛋白在四种不同条件下的冷冻电镜三维结构:不添加任何激动剂的“apo”-CaSR的inactive状态电镜结构;同时结合 L-Trp和 Ca2+两种配体的active-CaSR结构;单独结合L-Trp的CaSR结构;单独结合Ca2+的CaSR结构。通过结构分析首次阐明了全长CaSR受体的完整激活机制(图2):首先,L-Trp紧密结合在CaSR的VFT配体结合口袋中,诱导VFT从开放状态变成关闭状态;然后高浓度钙离子结合到受体上,使二体CaSR胞外的VFT结构域围绕二体对称轴开始发生扭转;该扭转通过刚性的CRD结构域传递到TMD,使TMD单体互相靠近形成TMD二聚体;最终形成CaSR激活态构象,为下游的G蛋白结合以及信号传递提供基础。
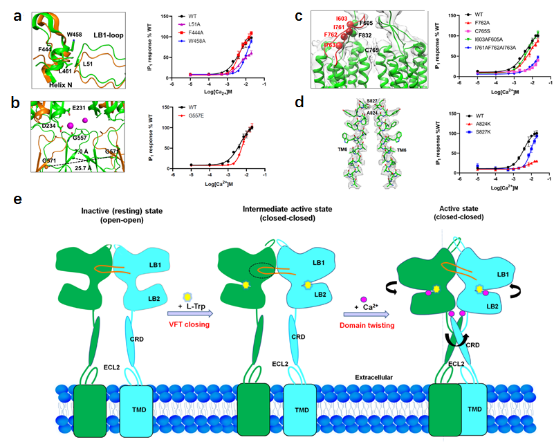
图2:钙敏感受体CaSR在Ca2+和L-Trp两种激动剂的共同作用下的激活机制
由于CaSR是重要的药物靶标,目前靶向CaSR的药物有三种:小分子药物evocalcet和cinacalcet,多肽药物Etelcalcetide。这三种药物都是钙拟剂,是CaSR的变构激活剂,然而他们对CaSR的变构调节机制目前还不是很清楚。本研究首次展示了全长CaSR蛋白的高分辨三维结构,特别是之前从未报道过的TMD结构。该结构信息使得后续以CaSR-TMD为靶点的别构调节药物设计和开发变得更加高效和准确。
中国科学技术大学的田长麟教授、孙德猛特任副研究员和清华大学的刘磊教授为本文的共同通讯作者。中国科学技术大学特任副研究员凌盛龙、石攀、刘三玲和博士研究生孟宪禹为论文的共同第一作者。中国科学技术大学为论文第一单位。中科大合肥微尺度物质科学国家研究中心的集成影像中心、浙江大学冷冻电镜中心和上海科技大学冷冻电镜平台为电镜数据收集提供了支持。论文封面艺术图由中国科学技术大学人文学院科技传播系黄雯副教授团队设计制作。
该研究工作获得了国家自然科学基金委、中国科学院、科技部和中国博士后科学基金会等项目支持。
论文链接:https://www.nature.com/articles/s41422-021-00474-0
