近日,中国科学技术大学龙冬教授课题组在癌基因蛋白Ras微秒时间尺度动力学及可成药“隐态”研究领域取得重要进展,相关成果以“Unveiling the ‘invisible’ druggable conformations of GDP-bound inactive Ras”为题发表于《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)。
如何开发出可特异性结合并调控疾病相关蛋白质的小分子化合物是靶向药物研究中的核心问题。著名的癌基因蛋白Ras作为细胞内的关键信号转导蛋白,被证实与约30%的人类恶性肿瘤发生密切相关。但因其构象基态缺乏明显的可成药位点或口袋,导致特异性的小分子抑制剂开发困难重重。鉴于此,对具有可成药潜力的构象激发态的探测显得尤为重要。然而,低布居数构象激发态的瞬时性特点导致它们常常无法在实验中被观测到(也因此被称为构象“隐态”),如何实现对蛋白质激发态的原子分辨率研究一直是核磁共振波谱学领域的前沿问题。
在之前工作中,龙冬教授课题组综合多种核磁共振弛豫实验方法定量捕捉到了非活性态Ras在微秒时间尺度的局部构象运动,并提出了以Ras“隐态”为设计靶点的可能性。但受快交换极限条件的制约,Ras构象运动的空间信息并无法直接从核磁弛豫实验中提取,这大大阻碍了利用蛋白质动态学性质进行理性药物设计的进程。针对这一挑战,该研究团队另辟蹊径,将微秒尺度运动引发的自旋弛豫、化学位移、残留偶极耦合等富含动态学信息的互补性实验参数与全原子模拟技术有机结合,借助高鲁棒性的全局优化算法建立了非活性态Ras的溶液系综。这一基于核磁实验参数的构象系综在原子水平上系统阐明Ras在生理条件下的热运动可及构象,并揭示了其表面暴露和深埋的隐式口袋的存在,为基于瞬态构象的靶向药物设计提供了高精度模板。更进一步地,该团队通过计算机虚拟筛选回溯性地测试了此系综从诱饵化合物中识别已知配体的能力,验证了基于系综的药物研发策略的可行性。这一工作中的整合性动态学分析和建模方法也为微秒时间尺度大分子构象运动的原子分辨率研究提供了可推广性范式。
该研究工作得到科技部、基金委和安徽省项目的资助。
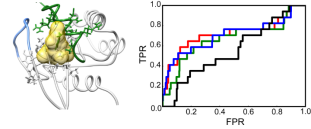
非活性态Ras的代表性隐式口袋构象及配体结合能力的回溯性测试。
论文链接:https://doi.org/10.1073/pnas.2024725118
