中国科学技术大学生命科学与医学部周丛照教授和陈宇星教授课题组,利用单颗粒冷冻电镜技术解析了人类磷脂翻转酶ATP8B1-CDC50及其与生理底物磷脂酰丝氨酸复合物的三维结构,并借助一系列生化实验阐明了ATP8B1的底物特异性及其活性调控的分子机制。相关研究成果以“Structural insights into the activation of autoinhibited human lipid flippase ATP8B1 upon substrate binding”为题于2022年3月30日在线发表在《美国科学院院报》(PNAS)上。
脂质双分子层的不对称性是真核生物细胞膜的标志性特征,维系一系列细胞功能,如膜稳定性、细胞形状、细胞信号传导以及胆汁和胆固醇稳态等。人类ATP8B1是一种P4型ATP酶,主要定位于肝脏的胆管细胞和小管膜上,利用ATP水解产生的能量将磷脂从细胞外膜翻转到内膜,对维持肝肠等细胞膜稳态具有重要作用。ATP8B1的功能缺陷会导致严重的人类疾病相关,如I型进行性家族性肝内胆汁淤积症(PFIC1),严重时将发展成肝胆管癌等疾病。
研究者结合体外ATP水解活性以及基于荧光标记的脂质翻转活性检测,首次利用生化手段证明了磷脂酰丝氨酸是ATP8B1的真正生理底物。结构比对发现,无配基的ATP8B1处于天然的磷酸化状态,其氨基端和羧基端分别插入三个胞内结构域之间,处于自抑制状态。这一首次发现的全新构象,更新了我们对P4型ATP酶转运循环的认识。在生理底物结合时,ATP8B1的自抑制状态将被解除。进一步的酶活实验发现,在生理环境中大量存在的胆酸盐能够极大地增强ATP8B1的酶活,表明胆酸盐在ATP8B1的活性调控中起着重要作用。结构分析发现,ATP8B1胞内的P结构域上具有一个独特的带正电的柔性结构(P-loop)与胆酸盐响应密切相关。这些研究结果阐明了ATP8B1介导的胆酸盐循环过程中膜脂不对称性修复的分子机理,揭示了ATP8B1在底物和肝内胆酸盐共同作用下的“自抑制-抑制解除-酶活增强”的精细调控机制,同时还为胆汁淤积症等疾病的治疗干预和药物设计提供了结构基础。
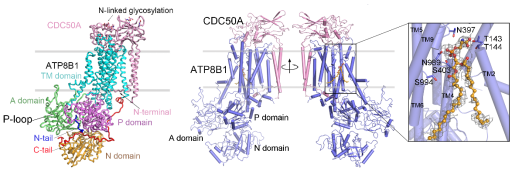
图1.无配基及底物结合ATP8B1-CDC50A复合物的三维结构
中国科学技术大学周丛照教授、陈宇星教授和侯文韬副教授为该论文的共同通讯作者,博士生程梦婷和陈宇为共同第一作者。冷冻电镜数据收集工作在中国科学技术大学冷冻电镜中心和中国科学院生物物理研究所完成。该研究得到了科技部、中国科学院和国家自然科学基金委的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2118656119
